| 1) | ラムネビンを洗浄し、一旦図のAまで水を入れる。図のA〜Bの部分までの水をビーカーに取り出し、炭酸水素ナトリウム2.5gを溶かす。 | 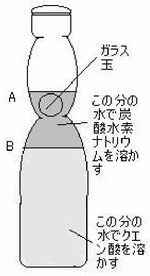 |
| 2) | 別のビーカーに残りの水を入れ、クエン酸、砂糖、レモンエッセンスを1〜2滴加える。 |
| 3) | ラムネビン、1と2のビーカーを氷水でよく冷やし、まず、2の溶液をビンに入れる。さらに、1の溶液をすばやくビンに入れ、ビンの口を指で塞ぎながらビンを逆さまにする。内部の圧力が高まり、ガラス玉がビンの口にしっかり止まったら、ビンを元通りに立て、さらに数回ビンを逆さにして液を混合する。ビンを冷却してから開栓して飲用してみる。 |
| [留意点・工夫点] |
| ・ | 炭酸水素ナトリウム2.5gが反応するのに必要なクエン酸は2.0gだが、多少酸味があるほうが味がよいので2.5g程度のクエン酸を加える。砂糖は12g程度。二酸化炭素が過剰に発生すると危険なので、炭酸水素ナトリウムの量は正確に量りとる。 |
| ・ | 実験前にクエン酸と炭酸水素ナトリウムの味や手触りを観察してみるとよい。 |
| ・ | この実験は、弱酸の塩(炭酸水素ナトリウム)がより強い酸(クエン酸)により分解され二酸化炭素が発生する反応である。
3NaHCO3 + C3H4(OH)(COOH)3 → C3H4(OH)(COONa)3 + 3CO2↑ + 3H2O |
| ・ | 液体に溶ける気体の質量は温度が一定のとき圧力に正比例する(ヘンリーの法則)。ラムネ作りでは発生する二酸化炭素によりビン内の圧力が高まり、ガラス玉がビンの口をしっかりと塞ぐ、口を塞がれたビン内の圧力が高まり多くの二酸化炭素が液体に溶け込む。ビンの口をあけると減圧により二酸化炭素が一気に気体となる。また、あらかじめ使用する水を冷やしておけば溶け込める二酸化炭素の量もさらに多くなる。 |

