8.淡水微生物の観察 |
| [目的] | 淡水中のいろいろな微生物を顕微鏡で観察し、その特徴を知る。 |
| A.ゾウリムシの観察 (参照 一般編「材料」ゾウリムシ) |
| [器具・材料] |
| | パスツールピペット テープスライドガラス(スライドガラスにパンチで穴をあけたビニールテープを貼ったもの)
ゾウリムシ |
| |
| ①遊泳運動の観察 |
| [準備および操作] |
| | ゾウリムシのいる培養液をテープスライドガラスに取り、カバーガラスをかけて観察する。 |
| [留意点・工夫点] |
| * | 遊泳運動の観察のときはゾウリムシがある程度自由に泳ぎ回ることができるようにする。 |
| * | テープスライドガラス(詳細については後述のスライドガラスの工夫を参照)で観察すると見失うことなく長時間でも乾燥せずに観察できる。 |
| |
| ②細胞構造の観察 |
| [準備および操作] |
| a) | 細胞全体 |
|
| | ・ | ゾウリムシの培養液をテープスライドガラスに1滴取り、塩化ニッケル溶液や硫酸ニッケル溶液を1滴混ぜて観察する。 |
| | ・ | 大きさ、形状、口の位置、内部の流動、繊毛をみる。 |
| b) | 核・・・・・酢酸オルセイン(カーミン)溶液で染色。大核は見えるが、小核は見えにくい。
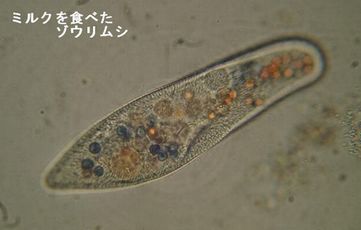
| | c) | 食胞・・・微量の墨汁液等を培養液に混ぜ、しばらくしてからテープスライドガラス上に入れ、カバーガラスをかけて観察する。
| | [留意点・工夫点] |
| * | ニッケルイオンは繊毛の動きを鈍くする。 |
| * | 繊毛が動かないと細胞口から食物が入らないので、観察の間は繊毛の動きを止めるものは使わない。 |
| * | 墨汁のかわりに脱脂粉乳(0.1%)とコンゴレッド(0.005%)の混合液を使う。また酵母菌を使ってもよいが、粒子が大きい。この場合は酵母菌を水に溶かしてコンゴレッドを入れよくかき混ぜる。早く染める場合は加熱する。 |
| * | 観察のポイント |
| | ・ | 脱脂粉乳はゾウリムシのどこから取り入れられるか。 |
| | ・ | 食胞はどこで作られているか。 |
| | ・ | 食胞はゾウリムシの体の中でどのように移動しているか。 |
| | ・ | コンゴレッドはpH3.5~5.0で赤から青になる。2~3分たったときに食胞の色はどのように変化するか。 |
| |  |
| d) | 細胞肛門 |
| [留意点・工夫点] |
| * | 形成された食胞は細胞内を移動しつつ細胞内消化を行う。消化されつくした食胞や内容物は細胞肛門から排泄される。 |
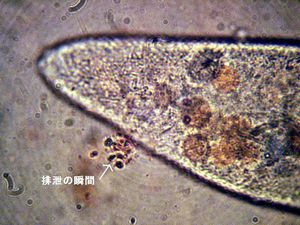 |
| * | カバーガラスの隙間から塩化ニッケル溶液をしみこませてゆっくり動きを止め、観察する。 |
| e) | 収縮胞 |
| [準備および操作] |
| | 時計皿に培養液と各濃度の食塩水(0.2~0.8%)と塩化ニッケル溶液を入れ、数分後パスツールピペットで採り1回の収縮に要する時間を測定する。 |
|
| [留意点・工夫点] |
| * | 外液濃度の変化に応じ収縮胞で体内液の浸透圧調整をおこなっている。 | 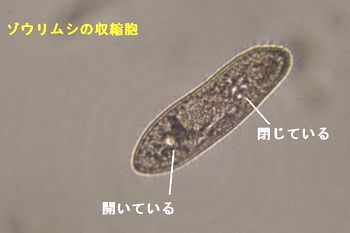 |
| * | 時計皿のゾウリムシは円を描くように揺すると中央に集まり易い。 |
| * | 収縮胞は一体に2個あるので、どちらか一方について、「丸く大きな中央胞がぽかっと消えたときから次に現れるまでの時間(秒)を1回の収縮に要する時間とする」測定は数回繰り返す。 |
|
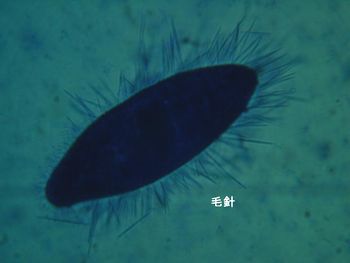
| f) | 毛胞 |
| |  細胞周辺部の透明な層 細胞周辺部の透明な層
ゾウリムシにピクリン酸や酢酸などの液、熱などの刺激を与えると毛胞から毛針(トリキニンというたんぱく質とCaが結合したもの)が細胞外へ放出される。 |
|
| [全体にかかる留意点・工夫点] |
| * | ゾウリムシの集め方 |
| | ① | 正の走光性、負の走地性を利用する。(数時間かかる) |
| |  |  |
| | ② | 負の走電性を利用する。
「実験28 走性」 参照 |
| | ③ | 遠心分離器を使う。 |
| | |  |
|
| * | スライドガラスの工夫 |
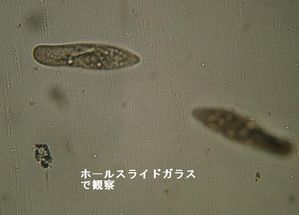
| | ① | ホールスライドガラスを使う。ただし水深があるためピントがあわせにくい。 |
|
|
|
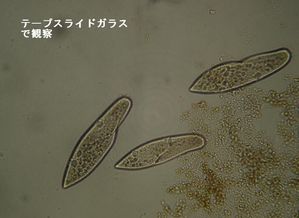
| | ② | テープスライドガラスを使う。
穴あきテープを貼る。水深が一定しているのでピントが合わせやすく見やすい。またカバーガラスがかけられる。ビニールテープの大きさはカバーガラスより小さいほうがよい。(後始末がしやすい) |
|
|
|
| * | ゾウリムシの動きを止める |
| | ① | 塩化ニッケル(0.005mol/lNiCl2)や硫酸ニッケル(0.005mol/lNiSO4)の他にメチルセルロースを使用してもよい。メチルセルロースは水で膨潤させ、シロップ状にしてから使用する。(濃すぎないように調節する0.1%濃度が適当) |
| | ② | 綿を使う。 |
|
| B.その他の微生物の観察 |
| [材料] | 池や川、水槽の水、各々の培養液 |
| [準備および操作] |
| | 微生物の入った液をスライドガラスにおき検鏡する。 |
| [留意点・工夫点] |
| * | 微生物の採集要領 |
| | ・ | 水が緑色に濁っている所や川の水がよどんでいる所などをビーカーですくい取る。水藻の群生を切出しナイフで削り落とし、持ち帰る。 |
| | ・ | 石の表面や底に沈んだ木の枝、木の葉、ゴミ、水中の草などは、そのままビンに入れて静かに持ち帰る。 |
| | ・ | プランクトンネットを引いても充分な量は集まらない場合もある。 |
| | ・ | 大雨から数日は水垢、水藻が流されて採集しにくい。 |
| | ・ | 目の細かい布の網で水を何回かすくい、網をビーカーの中で洗う。また、水中の小石や落ち葉を集める。 |
| * | スライドガラスを水槽中に沈めたり、立て掛けたりして一日置く。静かに取り出して付着した微生物を観察する。 |
| * | ゾウリムシ、アメーバ、ツリガネムシ、珪藻などは水面や中層には少なく、水底の植物の葉面、石の表面などに多い。 |
| * | 培養している試料は班ごとにサンプル瓶などに小分けしておくとよい。 |
| * | ボルボックスなどの少し大きいものにはホールスライドガラスの代わりにテープスライドガラスのテープを2枚にしたものを利用するとよい。 |
| |
|
|
|
| <参 考> |
| A.海水微生物の観察 |
| 海の生態系において重要な位置を占める海洋プランクトンを観察する。 |
| [材料] | 海水 |
| [準備および操作] |
| | プランクトンネットで海水中の微生物を採集し、その液をスライドガラスにおき検鏡する。 |
| [留意点・工夫点] |
| * | 顕微鏡に海水が付着しないように気をつけて検鏡する。実験終了後は顕微鏡をきれいにふいておく。 |
| * | 採集した微生物は容器に入れ、海水ごと冷蔵庫に保管しておくと数日間は生きた材料を観察できる。 |
| * | おもしろ科学実験「海の珪藻」を参照。 |
| |
| B.活性汚泥の微生物の観察 |
| おもしろ科学実験「水を浄化する微生物たち」を参照 |
|



 細胞周辺部の透明な層
細胞周辺部の透明な層