9.燃料電池 |
| もくじへ |
| [目的] | 電気分解によって生じた水素や酸素を使って、クリーンエネルギーについて知る。 |
| [領域] | 物理:電気 化学:物質の変化 環境:エネルギー |
| [準備] | 水酸化カリウムKOH水溶液 炭素棒 リード線 電子オルゴール 発光ダイオード ブザー 電源 ホフマンの電解装置 |
| [操作] |
| 水の電気分解によって生じた水素と酸素を炭素棒に吸蔵させて、電解質溶液中で放電させて電気エネルギーを得る。オルゴールやブザー、ダイオードを作動させる。 |
| [留意点・工夫点] | ||
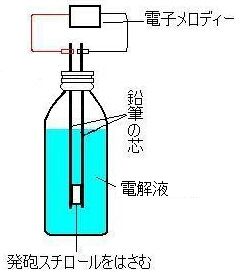
| ・ | 装置にはペットボトルなどを利用する方法もある。 |  |
| ・ | 炭素電極を用いるのは、炭素が多孔質で気体を蓄えることができるからである。放電時間を長くするためにニッケルメッキやパラジウムメッキを施す方法もある。 | |
| ・ | 電解液を水酸化カリウム水溶液の代わりに中性の10%程度の硫酸ナトリウム水溶液を用いてもよい。充電の際、正極付近は酸性、負極付近はアルカリ性になり放電で1.95Vぐらいの電圧が得られる。 | |
| ・ | 電解液にBTB指示薬を入れておくと酸・アルカリの呈色反応が観察できる。 | |
| ・ | 電解液に食塩水を用いると水素・塩素燃料電池が作れて2.5Vぐらいの電圧が得られる。 | |
| ・ | 水素などを燃料として、正極では還元反応、負極では酸化反応をおこし、その反応のエネルギーを電気エネルギーとして取り出す装置を燃料電池という。燃料と酸素を外部から連続して供給し、長時間にわたって電流を取り出せるので一種の発電装置ともみられる。電解質溶液がアルカリ水溶液の場合、充電中電極付近では次のような反応がおこる。 | |
| 正極 2OH− → 1/2O2 + H2O + 2e− | ||
| 負極 2H2O + 2e− → H2 + 2OH− | ||
| ・ | 燃料電池の長所と短所 | |
|
| もくじへ |