溶液の作り方(実際)
① モル濃度(mol/l)・・・・溶液1リットル中に溶けている溶質のモル数で表す。
| 溶質の質量(g)/溶質の式量 | =モル濃度(mol/l) |
 |
| 溶液の全体積(リットル) |
② パーセント濃度(%)・・・・溶液全質量に対して溶けている溶質の質量を百分率で表す。
| 溶質の質量(g)/溶液の全質量(g)×100=パーセント濃度(%) |
- (例)結晶水を含んだ硫酸銅の5%溶液100gを作る。
- 5×CuSO4・5H2Oの式量/CuSO4の式量=5×249.6/159.6=7.82g
∴硫酸銅(Ⅱ)5水和物の結晶7.82gを水100g-7.82g=92.18gに溶かせばよい。
簡易調製法(液体) |
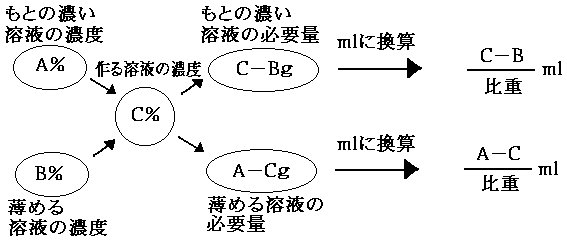 |
 |
|
(例) 市販の濃塩酸を水で薄めて15%塩酸にする。 |
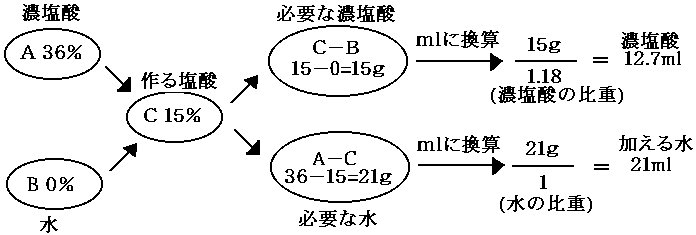 |
| |
<参 考>
規定濃度(N)・・・・・・溶液1リットル中に溶けている溶質のグラム当量数を表す。
| 溶質の質量(g)/溶質の1グラム当量 | =規定濃度(N) |
 |
| 溶液の全体積(リットル) |
- 例)0.10Nシュウ酸溶液100mlを作る。
- (COOH)2・2H2O(式量126)の1グラム当量=126g/2価=63g
100ml中のシュウ酸は0.1×100/1000 =0.01(グラム当量)
∴63×0.01=0.63すなわち、シュウ酸の結晶0.63gを水に溶かしてメスフラスコで全体の体積を100mlにする。
|


