40.ハロゲン
| [目的] | ハロゲンの性質について調べる。 |
| [薬品・材料] | |
| さらし粉 塩酸HCl ヨウ素I2 塩化カリウムKCl 臭化カリウムKBr ヨウ化カリウムKI でんぷん水溶液 塩素Cl2水 臭素Br2水 青色リトマス紙 ヨウ化カリウムでんぷん紙 有色花 らせん状銅線 チオ硫酸ナトリウムNa2S2O3 |
|
| [器具] | 集気瓶 ガラス板 ふたまた試験管(さ状ガス発生器) ゴム栓付き気体誘導管 |
| [操作] | |
| 1) | 塩素の発生とその性質 |
 |
|
| 2) | ヨウ素の性質 |
| ① | ヨウ素の結晶を1個試験管に取り、水を加えてよく振ってヨウ素が水に溶けるかどうかを調べる。続いてヨウ化カリウムの結晶を数個加えて振り混ぜてみる。 |
| ② | デンプン水溶液を2本の試験管にとり、一方にヨウ化カリウム水溶液、他方に①の溶液を加えて色の変化を見る。 |
| 3) | ハロゲンの化合力 |
| ① | 試験管に塩化カリウム、臭化カリウム、ヨウ化カリウムの各水溶液をとり、塩素水や臭素水を加えて変化を見る。 |
| ② | 反応の結果、ヨウ素が生じたと思われるものにデンプン水溶液を加えて色の変化を観察する。 |
| [留意点・工夫点] | |
| ☆ | 塩素・臭素・ヨウ素は人体に有毒である。気体を吸うと、粘膜を刺激しめまいや頭痛・炎症等を起こす。教室の換気には充分注意し、洗浄はドラフト内で行なう。 |
| ☆ | さらし粉は、高温時は容器の内圧が上がっているので開封時には試薬の飛散に気を付ける。最近は飛散しにくい顆粒状のものが市販されている。 |
| ☆ | さらし粉は水分を吸収し劣化する。生徒用に小分けする時は必要な量だけ入れるようにする。 |
| ☆ | さらし粉の他に二酸化マンガン(加熱が必要)や過マンガン酸カリウムを使用してもよい。 |
| ☆ | 塩素は空気より重いため、発生時は試験管の先を集気瓶の底まで深く入れておく。 |
| ☆ | 気体の性質を調べる場合、試験紙等は水で湿らせてから使用する。 |
| ☆ | 漂白に使う有色花は鮮やかな赤色のものがよい。花びらが肉厚の場合、脱色するのに時間がかかるので薄い花びらを使用する。水で濡らすと脱色が早い。朝、花だけを摘んで冷蔵庫に入れておくとよい。有色花の代わりに赤インクや水性ペンを染みこませたろ紙を使ってもよい。 |
| ☆ | 塩素捕集後は、三角フラスコに30mlほど入れたチオ硫酸ナトリウム溶液(脱塩素剤として、亜硫酸水素ナトリウムや硫酸ナトリウムでも可)を用意した中に誘導管の先を入れて、塩素を完全に反応させてから水洗いする。 |
| ☆ | 集気瓶にさらし粉を入れて塩素を発生させる場合は、実験終了後、水とチオ硫酸ナトリウムの固体(水溶液でも可)を入れてガラス板でフタをし、よく振って塩素ガスを充分に反応させる。 |
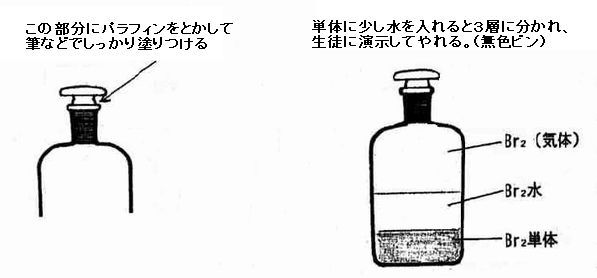
| ☆ | 生徒実験に使用する量はわずかなので、臭素の単体を購入するときは25g入りアンプルを購入する。 |
| ☆ | 臭素はアンプル瓶から出し、瓶に純水と共に入れて臭素水として使用する。市販されている臭素水を使ってもよい。残ったアンプル瓶の臭素は、軟性試験管やガラス管に入れて封じたり、共栓の細口瓶に移してパラフィンで封じておくと臭素が抜けにくい。無色の試薬瓶で保管するときは、アルミ箔で光を遮蔽するのを忘れないようにする。 |
 |
|
| ☆ | ヨウ素がこびりついた時は、ヨウ化カリウム溶液に溶かしてとるとよい。 |
| ★ | さらし粉を扱う時は、金属さじを使用しない。 |
| ★ | ふたまた試験管や集気瓶は乾いたものを使用する。 |
| ★ | 銅線は太めのものを購入し、ペンに巻き付けらせん状にして、適当な長さに切ってコルク栓にさすと使いやすい。 |
| ★ | 塩素中で燃やした銅線には塩化銅がついているので、塩酸で洗ったあと水洗いし、焼いて表面を酸化銅にしておく。 |
| <参考> | ||
| ○臭素・ヨウ素の作り方 | ||
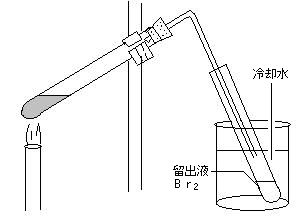
| 臭 素: | 臭化カリウム0.5gと二酸化マンガン0.5gをよく混ぜて試験管に入れ、水2~3滴加えてから9mol/l硫酸を4ml加えて強熱し、発生する気体を冷却しながら下方置換で捕集する。 | |
 |
||
| ヨウ素: | ヨウ化カリウム0.5gと二酸化マンガン0.5gを混ぜて濃硫酸1mlを加えて加熱する。冷却して固体として捕集する。この時、ガラス管は固体が付着して詰まるので使用しない。 | |
| ○ハロゲンの酸化力の強さ | ||
| F2>Cl2>Br2>I2 | ||