38.硫黄の化合物の性質 |
| [目的] | 硫黄の化合物である硫化水素・二酸化硫黄をつくり、それらの性質を調べる。 |
| [薬品・材料] |
| | 硫化鉄FeS 塩酸HCl ヨウ素ヨウ化カリウム溶液I2-KI 硝酸銀AgNO3
硫酸銅(Ⅱ)CuSO4 酢酸鉛Pb(CH3COO)2 硫酸鉄(Ⅱ)FeSO4 硫酸亜鉛ZnSO4
アンモニアNH3水 硫黄S リトマス紙 有色花 |
| [器具] | 気体誘導管 燃焼さじ 集気瓶 ガラス板 |
| [操作] |
| 1) | 硫化水素水を作る |
| | 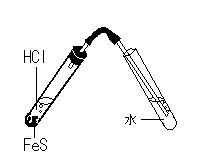 |
| 2) | 硫化水素の性質を調べる |
| | 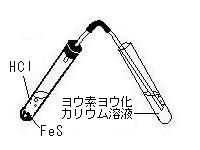 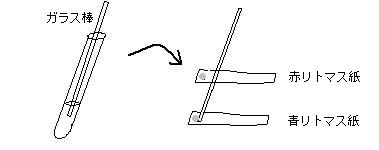 |
|
| <参考1> |
| 青色リトマス紙は、空気中の二酸化炭素の影響により青みが薄れていることが多い。リトマスを水に溶かしてもう一度しみこませ、乾燥させてから使用する。または、アンモニアの蒸気に触れさせて修正しておくのもよい。 |
|
| |  |
| 3) | 二酸化硫黄の捕集 |
| | 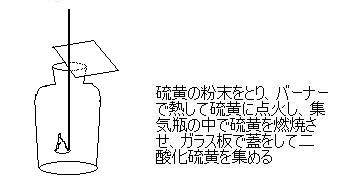 |
| 4) | 二酸化硫黄の性質 |
|
| ① | 発生した気体の色・においを調べる。 |
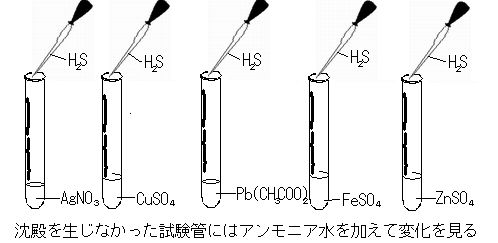
| ② | 集気瓶の中に水で湿らせたリトマス紙・ヨウ素ヨウ化カリウム溶液をしみ込ませたろ紙・有色花を入れて変化をみる。 |
| ③ | 集気瓶の中のリトマス紙などをピンセットで取り除き、硫化水素水を集気瓶の中に入れ、ガラス板で蓋をして上下によく振り混ぜて変化をみる。 |
|
| [留意点・工夫点] |
| ☆ | 硫化水素は無色の気体で腐卵臭に似た独特の臭いがある。臭いになれると悪臭を感じなくなり、多量に吸入してしまうことがあり危険である。極めて有毒で中枢神経が麻痺して死亡することもあるので注意する。吸入したときは新鮮な空気を吸入させる。 |
| ☆ | 硫化水素の毒性を考慮すると、生徒実験では発生させず、実験前に硫化水素水として準備するのが望ましい。作業は必ずドラフト内で行い、部屋の換気に注意する。 |
| ☆ | 硫化水素を発生させる時、反応しにくい場合は少し暖めるとよい。 |
| ☆ | 硫化水素水は時間がたつと硫黄の沈殿物ができるので、できるだけ使用直前に作る。 |
| ☆ | 塩酸の代わりに硫酸を使ってもよい。 |
| ☆ | 硫化鉄はできるだけ細かく砕いて使用するとよい。 |
| ☆ | 使用した硫化鉄は回収してよく洗い、乾燥させてから保管する。再使用の際はさびを落としてから使用する。 |
| ☆ | 二酸化硫黄は刺激臭をもつ無色の気体。粘膜を侵し有毒である。 |
| ☆ | 二酸化硫黄は亜硫酸ナトリウムに希硫酸を加えて発生させてもよい。銅と熱濃硫酸を反応させても生成される。 |
|
| <参考2> |
| 二酸化硫黄は反応する相手によって酸化剤にも還元剤にもなる物質である。他に過酸化水素も同様の性質を持つ。 |
|
| ★ | 燃焼さじの汚れは、しばらく水に浸けておけばとれる。 |
| ★ | 硫化水素の発生を途中で止めたい時は、ふたまた試験管(さ状気体発生器)を使う方がよい。 |
|
| <参考3> |
| 多量に硫化水素を発生させたい時はキップの装置を使うと便利である。ふたまた試験管と同様にコックを閉めることにより発生を途中で止められる。 |

コックを閉じた状態でセットし、塩酸を注ぐ。 | | 
コックを開くと塩酸が硫化鉄と反応し、硫化水素が発生する。閉じれば反応を止められる。 |
|






