19.反応熱
| [目的] | 溶解熱、中和熱を測定することにより、反応熱の総和が、変化の経路や方法に無関係である(ヘスの法則)ことを確認する。 |
| [薬品] | 水酸化ナトリウムNaOH(粒) 塩酸HCl |
| [器具] | 発泡ポリスチレン保温容器 温度計 メスシリンダー |
| [操作] | |
| 1) | 水酸化ナトリウムの溶解熱を測定する。 |
 |
|
| 2) | 水酸化ナトリウム水溶液と塩酸との反応熱を測定する。 |
 |
|
| 3) | 固体の水酸化ナトリウムと塩酸との反応熱を測定する。 |
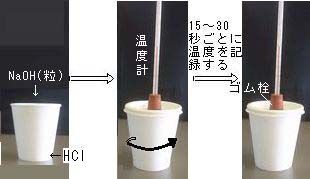 |
|
| [留意点・工夫点] | |
| ☆ | 水酸化ナトリウムと塩酸は新しいものを使う方が、より正確な結果が得られる。 |
| ☆ | 塩酸の濃度は水酸化ナトリウムを完全に反応させなければならないので、1mol/lより少し濃い方がよい。(1mol/l塩酸1リットルに濃塩酸を1滴入れる程度) |
| ☆ | 実験の際、水酸化ナトリウム(粒状)は、空気中の水蒸気を吸って質量が変化してしまうので蓋のできる容器に小分けしておく。 |
| ☆ | 純水や試薬は長時間常温中に置いたものを使用する。 |
| ☆ | 試薬は濃度の同じものを使用する必要があるので、多めに用意しておく。 |
| ★ | 温度計は、穴の開いた容器の蓋に、穴を開けたゴム栓で上下からはさんで固定する。 | 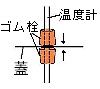 |
| ★ | 蓋の穴は、コルクボーラーやガラス棒を少し熱して回しながら力を加えるときれいに開く。 | |
| ★ | 試薬を量りとるメスシリンダーは、テープで色分けして使い分ける。 | |
| ★ | 温度計は、1/10か1/5の目盛りのものを利用する。50℃までの目盛りのものでも可。(最高温度47℃) | |
| ★ | 溶液を撹拌するのにマグネティックスターラーを使用すると便利である。その際、温度計の先に回転子が触れないように注意する。 | |
| ★ | 蓋は使用しなくても大きな誤差はない。 | |
| <参考> | |
| ◎ | 水酸化ナトリウムは粒状なので2.0gちょうどを量り取ることは難しい。実験書に見られる「水酸化ナトリウム(粒)約2gを正確に量る」とは、 「2g前後の量を取り、その質量を正確に読みとる」という意味。 潮解性があるので、すばやく量らなければならない。 |