16.溶解度曲線
| [目的] | 固体の溶解度が温度によってどう変わるかを調べ、グラフに表す。 |
| [薬品] | 硝酸カリウムKNO3 |
| [器具] | ホールピペット 温度計 |
| [操作] | |
| 1) | 硝酸カリウムを正確に計りとり、試験管に入れる。 |
| 2) | ホールピペットで正確に計った水を1の試験管に加える。 |
| 3) | ビーカーの沸騰水中につけ、加熱溶解する。 |
| 4) | その後、空気中に取り出し、かき混ぜながら冷却し、再び結晶が析出する温度を測定する。 |
  |
|
| [留意点・工夫点] | |
| ☆ | 硝酸カリウムはできるだけ正確に計りとる。 |
| ☆ | 使用した硝酸カリウムは回収して再結晶させ、乾燥後乳鉢で粉末にし、容器に明記して保存し、翌年再利用する。 |
| ☆ | 純水はきれいな試験管に多めにとっておき、それをホールピペットで計って加えていくようにする。直接ピペットを純水の容器の中に入れない。 |
| ★ | 温度を下げていくのに、気温の高い時期は下がりにくいので、ビーカーに水を用意し、時々水につけては、かき混ぜることで時間の短縮ができる。 |
| <参考1> |
| 一定の溶媒に溶ける溶質の最大量を、その溶媒に対する溶質の溶解度という。 固体の溶解度は、溶媒100gに溶かすことのできる溶質の質量(g)、または飽和溶液100gに溶けている溶質の質量(g)で表される。 |
| <参考2> | |
| 再結晶とは、少量の不純物を含む固体から、温度による溶解度の違いを利用して不純物を取り除き、固体物質を精製する操作のこと。 | |
| 例) | 硝酸カリウムKNO3と硫酸銅(Ⅱ)CuSO4・5H2Oの混合物を温水に溶かす。冷却すると硝酸カリウムだけが飽和になり、結晶となって析出する。 |
| <参考3> |
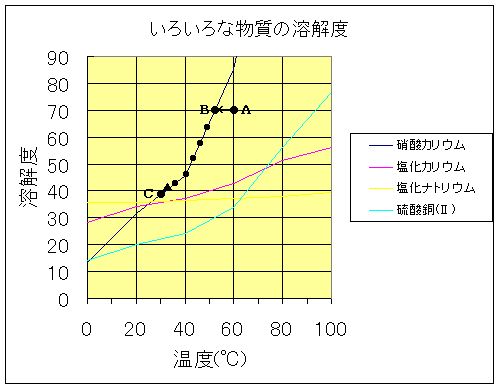 |
| 溶解度曲線とは、いろいろな温度における固体の溶解度をグラフに表したもの。 A KNO370gを60℃の温水100gに溶かす B よりも温度が下がると結晶が析出し始める C さらに冷やすと結晶が多量に析出する |